Патоморфологическая и иммунофенотипическая оценка эффективности и безопасности различных способов применения экзосом в условиях in vivo
© С.В. МУРАКОВ¹,², А.А. ВЕРЕВКИН³, Н.Г. КАЛАШНИКОВА⁴, Е.А. РАЗУМОВСКАЯ⁵, О.М. КАПУЛЕР⁶
¹ Академия постдипломного образования ФГБУ «Федеральный научно-клинический центр специализированных видов медицинской помощи и медицинских технологий ФМБА России», Москва, Россия;
² ООО «Лотос 288», Москва, Россия;
³ ФГБОУ ВО «Кубанский государственный медицинский университет», Краснодар, Россия;
⁴ Сеть клиник «Линлайн», Москва, Россия;
⁵ ООО «Ренессанс-Косметология», Самара, Россия;
⁶ ЗАО «Центр косметологии, пластической и реконструктивной хирургии», Уфа, Россия
РЕЗЮМЕ
Актуальность. Экзосомы — это мембранные везикулы, несущие функцию межклеточной коммуникации, они влияют на пролиферацию и дифференцировку клеток, апоптоз, ангиогенез, иммунный ответ. Эти свойства делают экзосомы привлекательными для разработки терапевтических стратегий в дерматологии и эстетической медицине. Обсуждаются предположения о потенциальной связи применения экзосом с такими эффектами, как канцерогенез, аутоиммунизация и нарушение миграции фибробластов, однако данные остаются дискуссионными. Предполагается возможность экзосом утилизироваться на поверхности кожи, не достигая подлежащих тканей.
Цель исследования. Оценить канцерогенный потенциал, иммуногенные свойства, способность влиять на клетки дермы препарата экзосом из мезенхимальных стволовых клеток жировой ткани человека и внеклеточных везикул растений в условиях экспериментальной модели.
Материал и методы. Экспериментальную модель рубцовых изменений кожи воспроизвели на крысах линии Wistar (n=16). В 1-й группе животные получали экзосомы местно после воздействия дермабразией, во 2-й группе — подкожно, в 3-й группе после обработки дермабразией животные получали 0,9% раствор NaCl, в 4-й группе животные не подвергались обработке. Животных вывели из эксперимента, фрагменты кожи подвергли гистологическому и иммуногистохимическому анализу. Выполнили компьютерную морфометрию и статистическую обработку результатов.
Результаты. Гистологическое исследование выявило уменьшение фрагментации коллагена и большое количество капилляров в образцах 1-й и 2-й групп. Иммуногистохимический анализ показал усиление синтеза коллагена III типа в этих группах по сравнению с группами контроля, отсутствие повышения экспрессии маркеров Ki67 и mTOR. Образцы, подвергшиеся обработке экзосомами, продемонстрировали преобладание M2-фенотипа макрофагов по сравнению с контрольными группами, содержание провоспалительных клеток во всех группах было сопоставимым. Способ применения существенно не повлиял на эффективность и безопасность.
Заключение. Проведенное исследование не дало убедительных данных о канцерогенном или провоспалительном эффекте экзосом, равно как и об их негативном влиянии на миграцию фибробластов, но продемонстрировало значительное усиление процесса управляемого ремоделирования волокнистого матрикса соединительной ткани.
Ключевые слова: экзосомы, экспериментальная модель, гистологическое исследование, иммуногистохимический анализ, неоколлагеногенез.
ИНФОРМАЦИЯ ОБ АВТОРАХ:
Мураков С.В. — https://orcid.org/0000-0003-4330-2570
Веревкин А.А. — https://orcid.org/0000-0002-4159-2618
Калашникова Н.Г. — https://orcid.org/0000-0001-5250-9288
Разумовская Е.А. — https://orcid.org/0000-0001-7879-6625
Капулер О.М. — https://orcid.org/0000-0001-5714-5495
Автор, ответственный за переписку: Мураков С.В. — e-mail: Stanislav@doctor.com
КАК ЦИТИРОВАТЬ:
Мураков С.В., Веревкин А.А., Калашникова Н.Г., Разумовская Е.А., Капулер О.М. Патоморфологическая и иммунофенотипическая оценка эффективности и безопасности различных способов применения экзосом в условиях in vivo. Клиническая дерматология и венерология. 2025;24(6):846–857. https://doi.org/10.17116/klinderma202524061846
Введение
Экзосомы — мембранные везикулы размером 50—200 нм, представляют собой ключевой инструмент межклеточной коммуникации и участвуют в переносе белков, липидов и нуклеиновых кислот между клетками. Их уникальная способность модулировать фундаментальные биологические процессы, такие как пролиферация, дифференцировка, апоптоз, ангиогенез и иммунный ответ, делает их чрезвычайно привлекательными для разработки новых терапевтических стратегий в дерматологии и эстетической медицине [1, 2].
Исследования показывают, что внеклеточные везикулы, включая экзосомы, полученные из различных источников стволовых клеток, оказывают разностороннее положительное воздействие на заживление ран. Например, экзосомы, полученные из мезенхимальных стволовых клеток (МСК) человека, способствуют восстановлению миокарда после инфаркта, активируют ангиогенез и подавляют воспаление за счет снижения уровня цитокинов, таких как TNF-α и IL-1β [3–5].
В контексте заживления кожи особый интерес представляет способность экзосом модулировать процесс формирования рубца. В гипертрофических рубцах ключевую роль играет провоспалительный и фиброгенный цитокин TGF-β на фоне низкой активности матриксной металлопротеиназы (MMP)-1, которая отвечает за расщепление коллагена. Напротив, в келоидных рубцах наблюдается высокое содержание MMP-1, что приводит к накоплению труднодеградируемых коллагеновых волокон и более агрессивному росту рубца [6]. Экзосомы демонстрируют многообещающую терапевтическую активность именно благодаря направленному воздействию на эти ключевые пути [7].
Ранее нами были получены убедительные результаты, свидетельствующие об эффективности применения экзосомального препарата Creabello EXO в лечении заболеваний кожи. Creabello EXO представляет собой гибридный экзосомальный комплекс, объединяющий в своем составе экзосомы МСК жировой ткани человека и растительные внеклеточные везикулы центральной азиатской и алого верха. Данное сочетание обеспечивает синергетический эффект воздействия на структуры кожи. Уникальность препарата определяется высокой концентрацией активных компонентов (33 млрд экзосом на 1 мл) и степенью очистки 99,8% [8].
Creabella EXO производится в ультрастерильных условиях с соблюдением многоуровневой системы контроля качества, включающей селективный отбор молодых клинически здоровых доноров, их комплексное скрининговое обследование, восьмикратную субкультивацию МСК с поэтапной очисткой, а также выделение экзосом методом ультрацентрифугирования. Процесс предусматривает комплексную оценку чистоты и безопасности экзосом, включающую ПЦР-диагностику, LAL-тест и контроль отсутствия контаминации. Методы сканирующей и просвечивающей электронной микроскопии подтвердили присутствие в составе лиофилизата и суспензии Creabella EXO типичных сферических структур с просветом размером от 50 до 200 нм [8].
Практическое применение экзосомальной терапии в дерматологии и косметологии включает лечение ран в период эпителизации, сочетание с устройствами микронилинга, аппаратными и инъекционными методами эстетической коррекции и процедурами удаления новообразований [9].
Однако, несмотря на несомненные позитивные эффекты, при применении экзосом существует ряд потенциальных нежелательных последствий, среди которых следует отметить канцерогенез, стимуляцию аутоиммунных процессов, нарушение миграции фибробластов [10–12].
Канцерогенный эффект экзосом связывают с теоретической способностью переносить онкогенные молекулы, индуцировать эпителиально-мезенхимальный переход (EMT), стимулировать пролиферацию и метастазирование, а также модифицировать микроокружение опухоли для создания благоприятных условий для ее роста [13]. Показано, что экзосомы из МСК костного мозга мышей с множественной миеломой содержат повышенные уровни IL-6 и способствуют росту опухоли, тогда как экзосомы из нормальных МСК ингибируют рост опухолевых клеток рака молочной железы [14]. Это создает парадоксальную ситуацию: биологический агент, предназначенный для лечения одной патологии, может одновременно оказывать протуморегенное действие при другой. Эти данные свидетельствуют о том, что канцерогенный или протуморегенный потенциал экзосом не является универсальным свойством, а зависит от множества факторов, включая источник клеток-доноров, условия их культивирования, состав самой везикулы и состояние клеток-мишеней. Это подчеркивает необходимость детального изучения каждого конкретного препарата на основе экзосом.
Ряд исследователей выражают обеспокоенность тем, что экзосомы могут утилизироваться на поверхности кожи, не проникая в подлежащие ткани, что объясняется сродством мембраны экзосомы фосфолипидам, выделяемым на поверхность эпидермиса [15]. Это вызывает сомнения в способности экзосом достигать сосочкового слоя дермы, в котором располагается большинство клеток-мишеней их биологически активных компонентов [16].
С учетом имеющихся данных представляется целесообразным проведение экспериментального исследования экзосом на модели рубцовых изменений кожи у экспериментальных животных, в ходе которого методом иммуногистохимического анализа можно будет оценить канцерогенный (митогенный) потенциал, а также способность влиять на клеточные элементы соединительной ткани.
Материал и методы
Для оценки эффективности и безопасности экзосом нами создана модель рубцовых изменений кожи у экспериментальных животных — крыс-самцов линии Wistar (возраст 5—6 мес, масса тела 250—270 г). Животных содержали в оборудованном виварии с приточно-вытяжной системой вентиляции и кондиционирования. Корм и воду размещали в клетках ad libitum. Для создания модели рубцовых изменений кожи в межлопаточной области производили линейный разрез, который затем местно обрабатывали 0,0005% раствором коллагеназы («БиоВитрум», Россия) ежедневно в течение недели. Непосредственно после обработки на рану направляли горячий воздух (170 °C, скорость потока 5 л/мин).
Через 1 нед животных разделили на 4 группы по 4 особи в каждой. В 1-й и 3-й группах кожу в области рубца обрабатывали косметологическим дермабрадером (ROST, КНР) с длиной игл 1 мм. Затем в 1-й группе поверхностно наносили суспензию Creabella EXO (Южная Корея), а в 3-й группе — физиологический раствор. Во 2-й группе животные получили упомянутую суспензию экзосом подкожно в виде 5 инъекций по 0,2 мл в области рубца. Кожу животных 4-й группы никак не обрабатывали.
Спустя 1 нед после начала обработки животных вывели из эксперимента путем введения летальной дозы тилетамина (Virbac, Франция). Кожу из области интереса иссекли и поместили в 10% раствор нейтрального забуференного формалина («БиоВитрум», Россия) на 1 сут. Затем фрагменты кожи подвергли гистологической проводке через спирты нарастающей концентрации, ксилол и парафин по стандартной методике, после чего изготовили парафиновые блоки. С помощью ротационного микротома RM2231 (Leica, Германия) из этих блоков изготовили срезы толщиной 5 мкм (для рутинного гистологического анализа) и 3 мкм (для иммуногистохимического исследования). Вторые поместили на предметные стекла с адгезивным покрытием (ThermoFischer Scientific, США).
Срезы окрасили гематоксилином и эозином (Sigma-Aldrich Scientific, США) по стандартной методике, провели иммуногистохимическое исследование с биотинилированными антителами и конъюгатом стрептавидин-пероксидазой. Первичные антитела были направлены на антигены коллагена I и III типов, рецептора гиалуроновой кислоты RHAMM, маркеров пролиферации mTOR и Kiel-67 (Ki67), а также ряда молекул межклеточной адгезии — MRC2, CD68, CD47 (все производства Abcam, Великобритания).
Для фотографирования препаратов использовали микроскоп IX41 (Olympus, Япония) с фотонасадкой MiChrome 5 (Photonics, КНР). Для компьютерной морфометрии использовали программу ImageJ (NIH, США). Морфометрия включала в себя определение общей площади среза, а также вычисление площади, занимаемой иммунореактивным продуктом, или количества клеток, дающих положительную реакцию. Затем это число было отнесено к площади среза, что дало относительную величину — плотность клеток в 1 мм², или коэффициент площади окрашивания (КПО, %).
Для статистической обработки использовали программу GraphPad Prism (Graph Soft, США). Статистический анализ включал в себя проверку характера распределения выборочных значений по критерию Шапиро—Уилка. Поскольку распределение во всех выборках отличалось от нормального, в качестве меры центральной тенденции выбрана медиана, значения представлены в виде медианы, первого и третьего квартилей — Me [Q₁; Q₃]. Для оценки достоверности различий выборочных значений использовали критерий суммы рангов Манна—Уитни—Уилкоксона. Применение данного критерия продиктовано небольшим размером выборок, включающих в себя в среднем по 10 наблюдений. Нулевую гипотезу отвергли при значении р меньше 0,05.
Результаты
В препаратах из участка рубца, окрашенных гематоксилином и эозином, выявляется картина образования грубой соединительной ткани с умеренно выраженным клеточным компонентом. В образцах животных 1-й группы отмечено большое количество веретеновидных фибробластоподобных клеток в поверхностных слоях дермы (рис. 1, а). У животных, получавших раствор экзосом подкожно, наблюдается аналогичная картина, однако у них несколько выше плотность микроциркуляторного русла (рис. 1, б). Гистологическая картина животных, кожу которых обрабатывали дермабрадером и физиологическим раствором, характеризовалась выраженным акантозом и формированием розеток из кератиноцитов, ассоциированных с волосяными фолликулами (рис. 1, в). Наконец, кожа животных без обработки имела картину рубцовых изменений поверхностных слоев дермы и выраженный акантоз с гиперкератозом (рис. 1, г). При исследовании рутинных гистологических препаратов из всех групп не обнаружено ни одной фигуры митоза в клетках дермы, что может косвенно свидетельствовать о низком онкогенном потенциале экзосом. Срезы, окрашенные гематоксилином и эозином, не демонстрировали признаков воспалительной клеточной реакции. Макрофаги были немногочисленны во всех полях зрения всех изученных образцов и располагались исключительно в периваскулярном пространстве.
Иммуногистохимическая реакция на коллаген I типа выявила максимальную экспрессию в образцах животных 2-й и 4-й групп, где его КПО достиг соответственно 26,1 [24,4; 27,5]% и 28,4 [27,1; 30,2]%. В образцах животных 1-й группы эта величина была меньше в 1,2 раза (p=0,061), а в образцах животных 3-й группы — меньше в 1,3 раза (p=0,047) по сравнению с образцами животных 4-й группы. Микрофотографии с результатами реакции представлены на рис. 2.
Оценка экспрессии коллагена III типа показала, что в образцах животных 2-й группы КПО коллагена превысил таковой 1-й группы в 1,3 раза (p=0,054), 3-й группы — в 4,2 раза (p=0,033), 4-й группы — в 6,1 раза (p=0,002). Результаты иммуногистохимической реакции представлены на рис. 3. Максимальное соотношение коллагенов III/I отмечено во 2-й группе — 1,2. Этот же показатель для 1-й группы составил 1,1 для 3-й группы — 0,7, для 4-й группы — 0,3.
Рецептор подвижности, опосредованный гиалуроновой кислотой, характеризовался значительной вариабельностью экспрессии в разных полях зрения в пределах одного препарата. В частности, в участках с выраженным волокнистым компонентом она была заметно ниже, чем в периваскулярном пространстве и в участках с преобладанием клеточного компонента. Количество RHAMM-позитивных клеток на 1 мм² среза было максимальным в 1-й и 2-й группах, статистически значимых различий между ними не выявлено. Экспрессия RHAMM во 2-й группе превзошла таковую в 3-й группе в 1,2 раза (p=0,042), в 4-й группе — в 1,6 раза (p=0,039). Микрофотографии с результатами реакции представлены на рис. 4.
Экспрессия mTOR принимала одинаково низкие значения во всех группах образцов. Большинство скоплений иммунореактивного продукта выявлено в области базального слоя эпидермиса, что соответствует физиологической роли данного маркера. В среднем содержание позитивных по парамициновому рецептору клеток не превышало 43,2 [41,6; 45,0] шт/мм². Между группами не выявлено статистически значимых различий. Микрофотографии с результатами реакции приведены на рис. 5.
Экспрессия Ki67 также была низкой во всех изученных образцах. Статистически значимых различий между группами животных не выявлено. Большинство Ki67-позитивных клеток приходилось на эпидермис, относительная величина экспрессии не превышала 18,8 [16,5; 20,3] кл/мм². В срезах из 1-й и 2-й групп отмечено также скопление
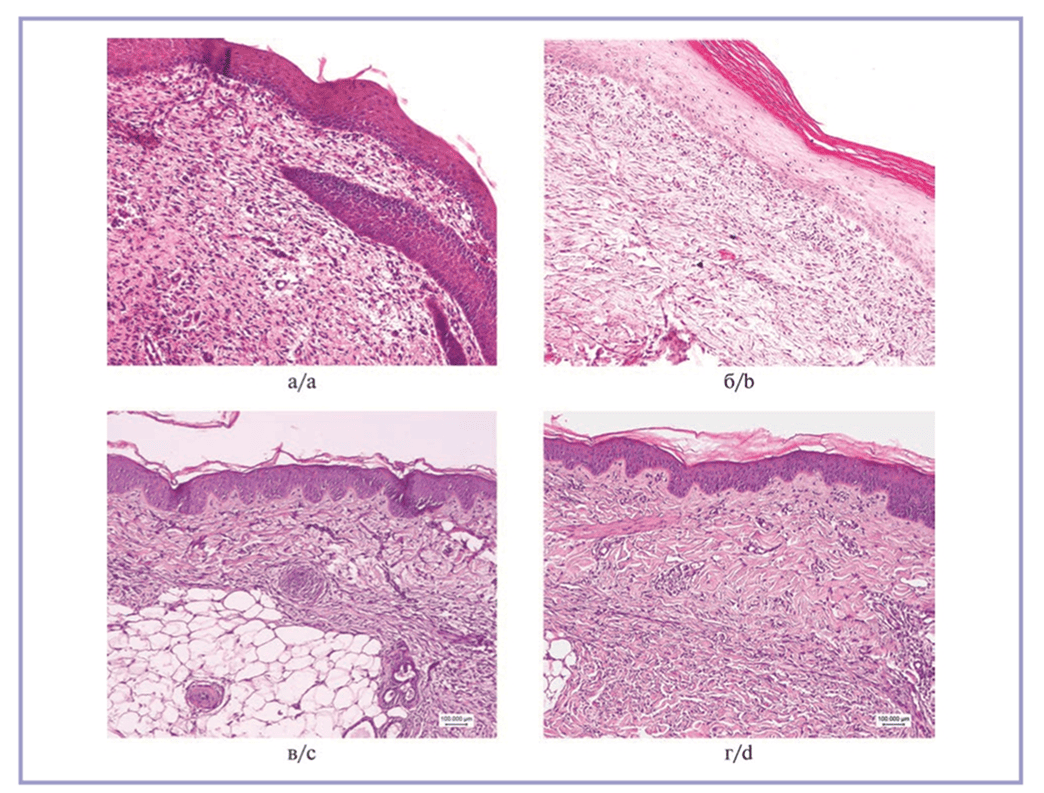
Рис. 1. Обзорная гистологическая картина кожи животных.
а — 1-я группа, выраженный неоангиогенез, богатый клеточный компонент в дерме; б — 2-я группа, незначительный гиперкератоз, многочисленные капилляры, хорошо развитый клеточный и волокнистый компоненты; в — 3-я группа, акантоз и паракератоз, розетки кератиноцитов в контакте с волосяными фолликулами; г — 4-я группа, акантоз и паракератоз, рубцовая ткань. Окраска гематоксилином и эозином, ×10.
Ki67-положительных клеток в стенках кровеносных капилляров. Микрофотографии с результатами реакции приведены на рис. 6.
Содержание частиц, распознающих антигенные детерминанты, было наивысшим в образцах из 2-й группы, однако не продемонстрировало статистически значимых различий с образцами из 1-й группы. КПО CD47 составил 12,2 [10,7; 14,1]% для образцов из 2-й группы, в 1-й группе он был в 1,1 раза ниже (p=0,055). В 3-й группе экспрессия была в 1,2 раза ниже, в 4-й группе — в 1,3 раза ниже, чем во 2-й группе (p=0,060). Микрофотографии с результатами реакции приведены на рис. 7.
Маннозный рецептор лектина типа C, характеризующий M2-подтип макрофагов, продемонстрировал значительно большую экспрессию в образцах из 1-й и 2-й групп. При этом позитивные макрофаги располагались дисперсно, преимущественно в верхних слоях дермы. В 1-й группе количество MRC2-позитивных клеток составило 8,5 [7,7; 9,2] на 1 мм², во 2-й группе — 10,0 [9,4; 10,7] на 1 мм². Статистически значимых различий между экспрессией MRC2 в 1-й и 2-й группах не выявлено. В 3-й группе КПО маннозного рецептора был ниже, чем в 1-й группе, в 1,4 раза (p=0,027), в 4-й группе — ниже, чем в 1-й группе, в 1,8 раза (p=0,022). Микрофотографии с результатами реакции приведены на рис. 8.
Общий макрофагальный кластер дифференцировки CD68 отмечен в небольших количествах во всех образцах четырех групп животных. Наибольшая его экспрессия — 12,2 [10,0; 14,1] кл/мм² отмечена в образцах из 3-й группы животных. В 1-й и 2-й группах его содержание было ниже соответственно в 2,5 раза (p=0,026) и 2,7 раза (p=0,019).
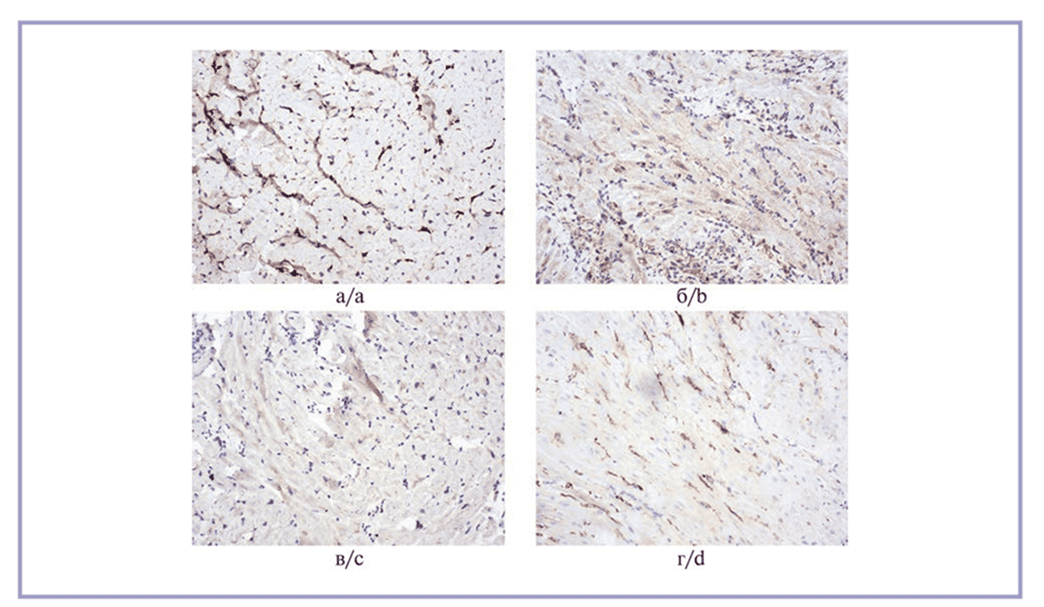
Рис. 2. Иммуногистохимическая реакция на коллаген I типа.
а — 1-я группа; б — 2-я группа; в — 3-я группа, умеренно выраженная реакция в большинстве полей зрения в дерме; г — 4-я группа, выраженная реакция во всех полях зрения в дерме. Стрептавидин-пероксидазная иммуногистохимическая реакция, ×10.
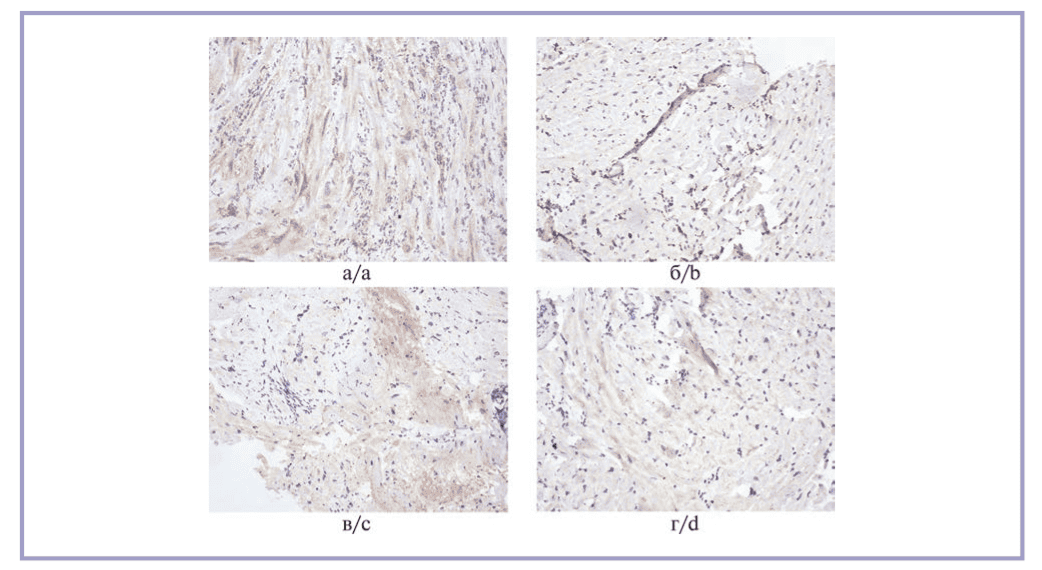
Рис. 3. Иммуногистохимическая реакция на коллаген III типа.
а — 1-я группа; б — 2-я группа, выраженная реакция во всех полях зрения в дерме; в — 3-я группа, умеренно выраженная реакция в большинстве полей зрения в дерме; г — 4-я группа, слабая реакция во всех полей зрения в дерме. Стрептавидин-пероксидазная иммуногистохимическая реакция, ×10.
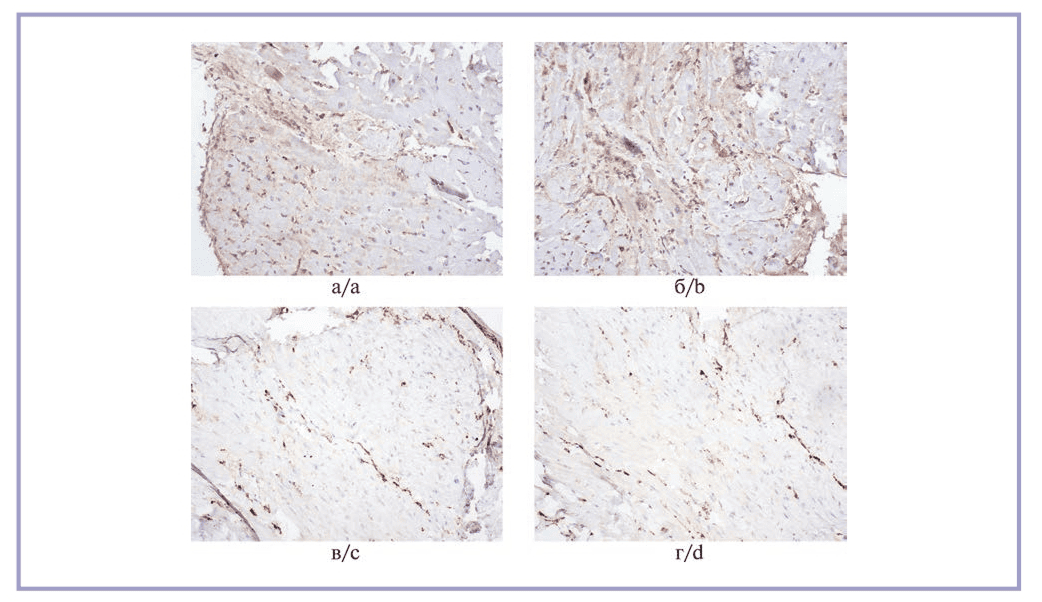
Рис. 4. Иммуногистохимическая реакция на RHAMM.
а, б — выраженная реакция во всех полях зрения в дерме, преимущественно периваскулярно, в образцах из 1-й и 2-й групп; в, г — умеренно выраженная реакция в клетках дермы в образцах из 3-й и 4-й групп. Стрептавидин-пероксидазная иммуногистохимическая реакция, ×10.
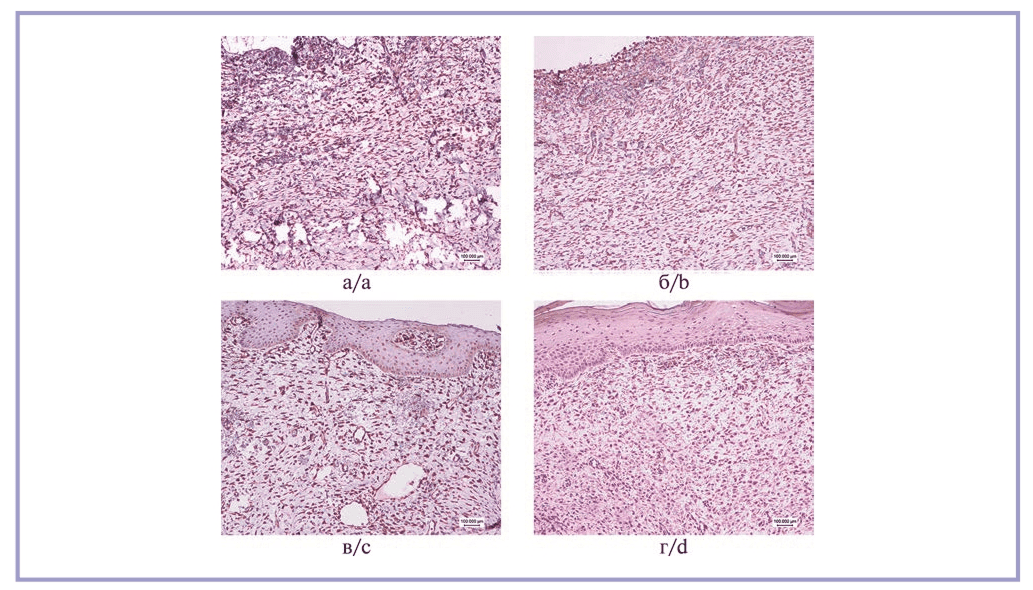
Рис. 5. Иммуногистохимическая реакция на парамициновый рецептор mTOR.
Во всех группах реакции умеренно выражена, преимущественно за счет эпителиальных клеток. Стрептавидин-пероксидазная иммуногистохимическая реакция, ×10.
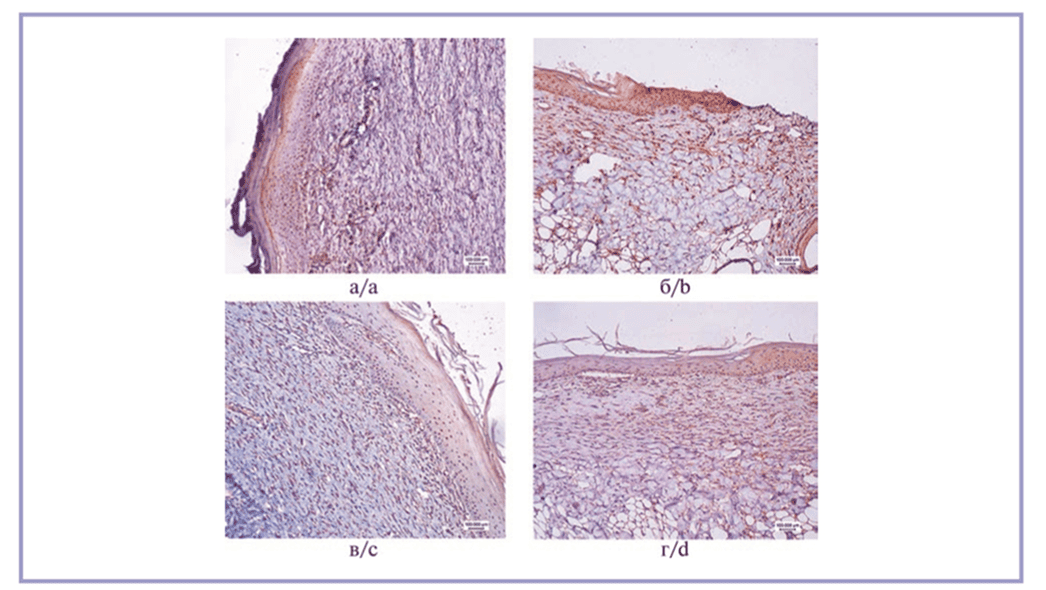
Рис. 6. Иммуногистохимическая реакция на антиген Kiel-67.
Во всех группах реакция умеренно выражена, преимущественно за счет эпителиальных клеток. Стрептавидин-пероксидазная иммуногистохимическая реакция, ×10.
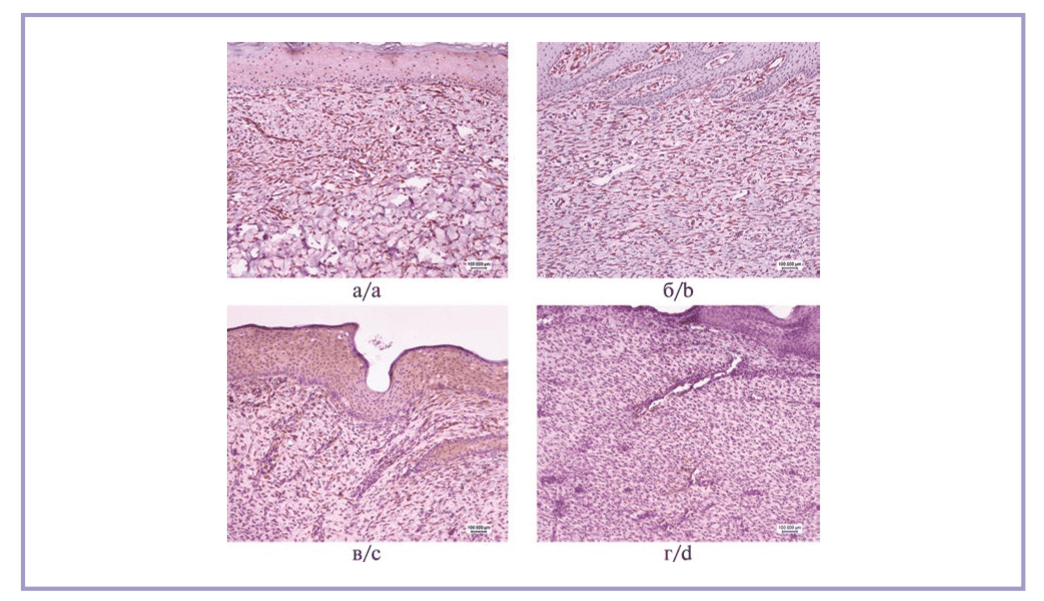
Рис. 7 Иммуногистохимическая реакция на антиген-распознающую частицу CD47.
а, б — умеренно выраженная реакция во всех полях зрения в дерме в образцах из 1-й и 2-й групп; в, г — слабовыраженная реакция в клетках дермы в образцах из 3-й и 4-й групп. Стрептавидин-пероксидазная иммуногистохимическая реакция, ×10.
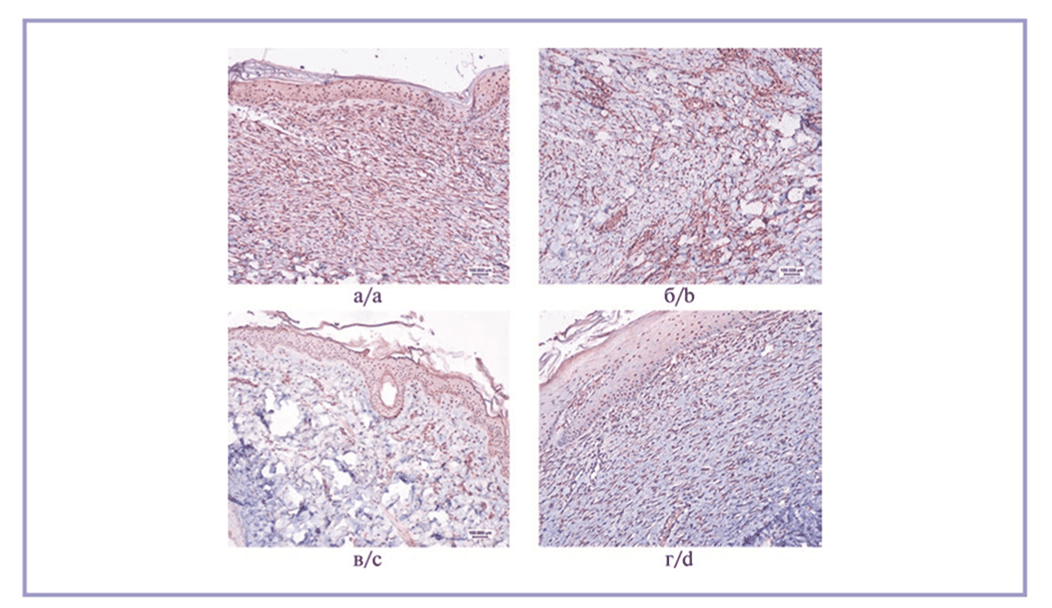
Рис. 8. Иммуногистохимическая реакция на маннозный рецептор лектина MRC2.
а, б — выраженная реакция во всех полях зрения в дерме в образцах из 1-й и 2-й групп; в, г — умеренно выраженная реакция в клетках дермы в образцах из 3-й и 4-й групп. Стрептавидин-пероксидазная иммуногистохимическая реакция, ×10.
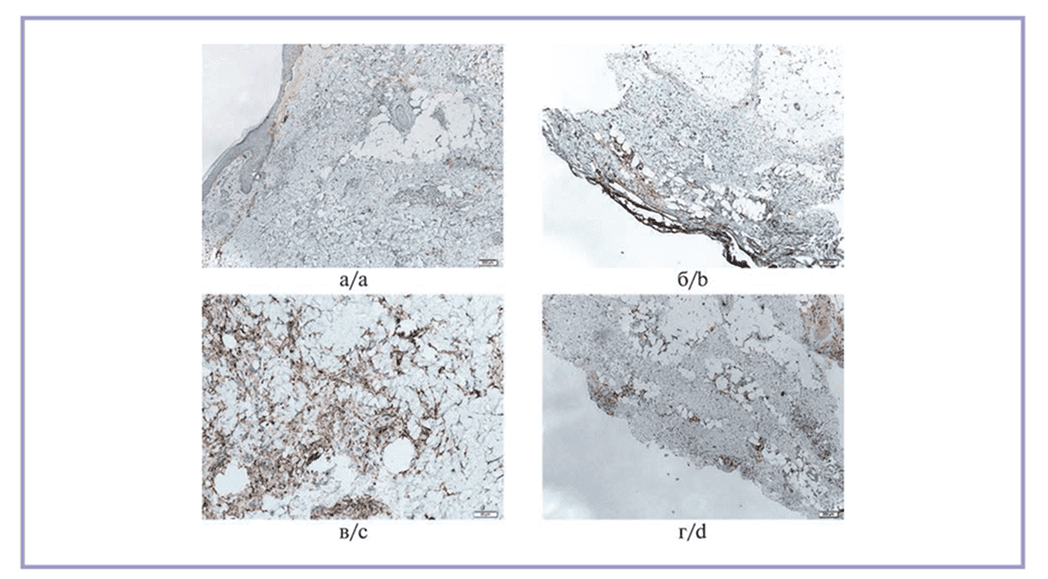
Рис. 9. Иммуногистохимическая реакция на макросиалин CD68.
а, б — слабая реакция во всех полях зрения в дерме в образцах из 1-й и 2-й групп; в — выраженная реакция в клетках дермы в образцах из 3-й группы; г — умеренно выраженная реакция в образцах из 4-й группы. Стрептавидин-пероксидазная иммуногистохимическая реакция, ×10.
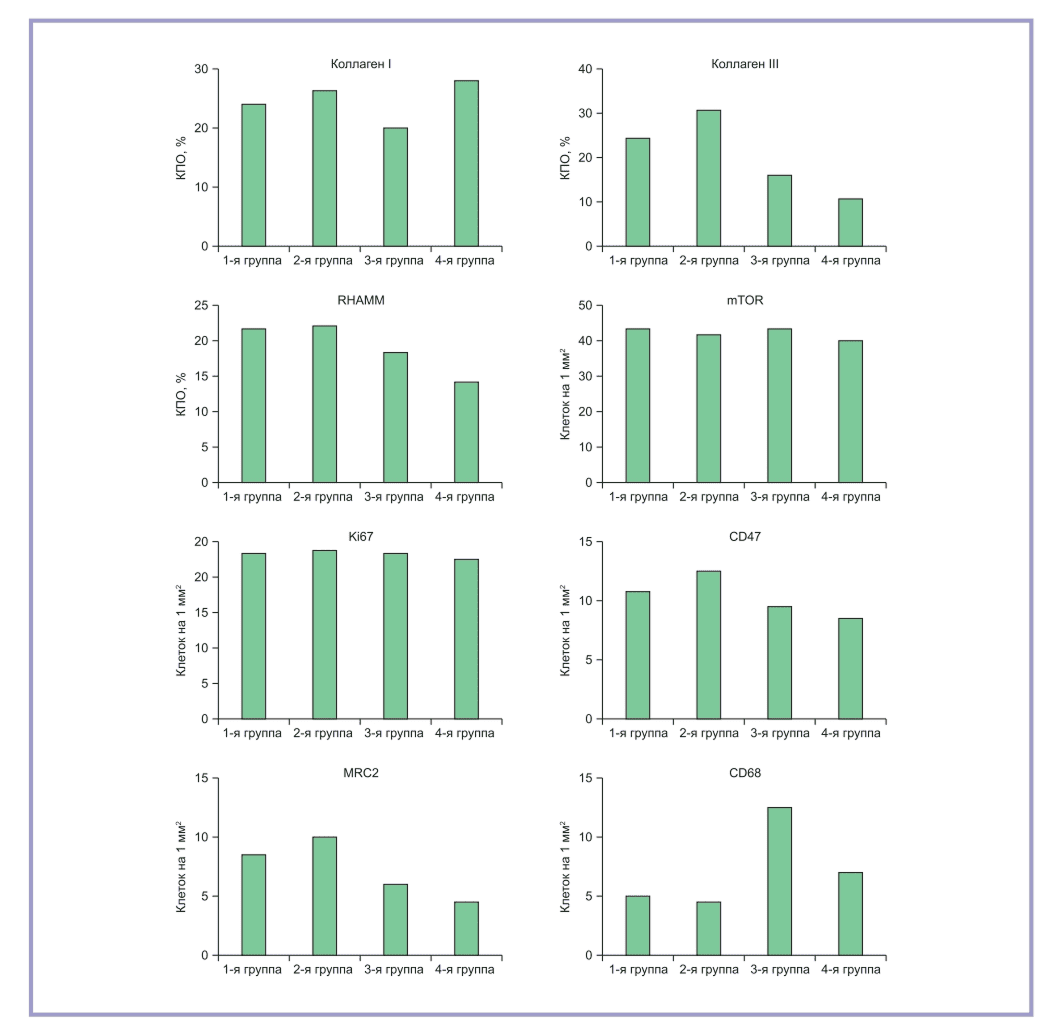
Рис. 10. Результаты компьютерной морфометрии основных иммуногистохимических маркеров
Микрофотографии, демонстрирующие окрашенные срезы, приведены на рис. 9.
Для оценки содержания M2-макрофагов мы использовали формулу MRC2/(CD68–MRC2). Данное соотношение тем выше, чем больше макрофагов имеют на поверхности маннозный рецептор лектина. В нашем исследовании наибольшее соотношение зарегистрировано в 1-й группе — 3,7, во 2-й группе это соотношение ниже в 2 раза (p=0,032), в 3-й группе — в 4,1 раза (p=0,010). Рис. 10 дает представление о результатах морфометрического анализа всех ключевых иммуногистохимических маркеров, задействованных в исследовании.
Обсуждение
Проведенные гистологический и иммуногистохимический анализы образцов показывают, что препарат на основе экзосом слабо влияет на деградацию коллагена I типа, о чем свидетельствует отсутствие статистически значимых различий в его экспрессии в экспериментальных и контрольных срезах. Из этого следует, что экзосомы, полученные из МСК, по-видимому, не вызывают значимой активации желатиназ, в частности MMP1. Эти результаты соотносятся с данными научной литературы, согласно которым экзосомы животного, в том числе человеческого происхождения, модулируют активность металлопротеиназ не напрямую, а опосредованно, через трансформирующий фактор роста.
В то же время повышение экспрессии коллагена III типа говорит об интенсификации неоколлагеногенеза, что играет ключевую роль в процессах регенерации. Считаем целесообразным провести в будущих исследованиях оценку аминотерминального пропептида проколлагена III типа, который обладает большей специфичностью и может свидетельствовать о потенциале активации фибробластов.
Данное исследование убедительно показало, что экзосомы из МСК жировой ткани человека и внеклеточных везикул растений способствуют хомингу фибробластов, о чем свидетельствует повышение экспрессии рецептора подвижности, опосредованной гиалуроновой кислотой (RHAMM). Эта молекула адгезии присуща только молодым фибробластам, сохраняющим способность к активному перемещению. Таким образом, можно говорить, что экзосомы МСК положительным образом влияют на миграцию фибробластов в зону введения, а также усиливают их активность. В дальнейших исследованиях считаем целесообразным оценить экспрессию молекул TWIST1 и уроқиназного рецептора CD87, чтобы установить преимущественный источник фибробластов в зоне введения экзосом.
В настоящем исследовании не выявлено значительного повышения пролиферативной активности в клетках кожи в ответ на введение экзосом. Об этом говорит низкая активность рецепторов рапамицина, представляющих собой компоненты белкового семейства, отвечающего за переключение фаз клеточного цикла. Низкой во всех группах животных остается экспрессия митотического антигена Ki67. Оба вышеупомянутых антигена в нашем исследовании демонстрировали преимущественно распределение в базальном слое эпидермиса, что является физиологическим явлением для эпителиальных тканей таней вообще. Эти данные могут свидетельствовать в пользу низкого онкогенного потенциала экзосом, поскольку опухолевой трансформации должно было предшествовать вхождение значительного числа фибробластов в митотическую фазу клеточного цикла, чего не наблюдалось в нашем исследовании.
Под действием препарата экзосом у животных также отмечено рекрутирование из моноцитов крови «регенераторных» M2-макрофагов, о чем свидетельствует значительное повышение маннозного рецептора лектина. Учитывая тот факт, что рецептор лектина есть также у эндотелиальных клеток и перицитов, для дифференциации их от макрофагов мы использовали двойную реакцию на серийных срезах — с антителами к маннозному рецептору и к макросиалину CD68. Для подсчета макрофагов разных групп оценивали соотношение этих макрофагальных антигенных детерминант.
Количественные характеристики экспрессии всех вышеперечисленных иммунофенотипических маркеров не позволили выявить более эффективный путь введения экзосом в организм. В большинстве случаев не выявлено статистически значимых различий в признаках у групп, в которых экзосомы вводили подкожно или наносили поверхностно после обработки дермабрадером. Полученные результаты свидетельствуют о сопоставимой эффективности обоих методов введения экзосом in vivo.
Заключение
Проведенное исследование не позволило рассматривать экзосомы как потенциальный канцероген, а также опровергло утверждения об их значительной иммуногенности. Кроме того, получены убедительные данные об их активирующем действии на фибробласты и о стимуляции выработки последними коллагена и, вероятнее всего, компонентов аморфного матрикса.
Финансирование. Исследование выполнено при поддержке ООО «Лотос 288».
Участие авторов:
Концепция и дизайн исследования — Мураков С.В., Веревкин А.А.
Сбор и обработка материала — Веревкин А.А., Мураков С.В.
Написание текста — Мураков С.В., Веревкин А.А., Калашникова Н.Г., Разумовская Е.А., Капулер О.М.
Редактирование — Мураков С.В., Веревкин А.А., Калашникова Н.Г., Разумовская Е.А., Капулер О.М.
Конфликт интересов: Мураков С.В. сотрудничает с ООО «Лотос 288».
ЛИТЕРАТУРА
Hade MD, Suire CN, Suo Z. Mesenchymal Stem Cell-Derived Exosomes: Applications in Regenerative Medicine. Cells. 2021;10(8):1959.
https://doi.org/10.3390/cells10081959
Vyas KS, Kaufman J, Munavalli GS, Robertson K, Behrar A, Wyles SP. Exosomes: the latest in regenerative aesthetics. Regen Med. 2023;18(2):181-194.
https://doi.org/10.2217/rme-2022-0134Zhang H, Wang Y, Feng K, Niu Q, Xin Y, Xuan S, Liu S. MiR-146a-5p-enriched exosomes inhibit M1 macrophage activation and inflammatory response by targeting CD80. Mol Biol Rep. 2024;51(1):1133.
https://doi.org/10.1007/s11033-024-10088-5Wang D, Zhang H, Chen Y, He J, Zhao L, Huang Y, Zhao F, Jiang Y, Fu S, Hong Z. Improving therapeutic effects of exosomes encapsulated gelatin methacryloyl/hyaluronic acid blended and oxygen releasing injectable hydrogel by cardiomyocytes induction and vascularization in rat myocardial infarction model. Int J Biol Macromol. 2024;271(2):132412.
https://doi.org/10.1016/j.ijbiomac.2024.132412Xiong YY, Gong ZT, Tang RJ, Yang YJ. The pivotal roles of exosomes derived from endogenous immune cells and exogenous stem cells in myocardial repair after acute myocardial infarction. Theranostics. 2021;11(3):1046-1058.
https://doi.org/10.7150/thno.53326.Angelina J, Putra A, Trisnadi S, Hermansyah D, Setiawan E, Sumarawati T, Amalina ND. Hypoxia-conditioned mesenchymal stem cells (MSC) exosomes attenuate ultraviolet-B (UVB)-mediated malondialdehyde (MDA) and matrix metalloproteinase-1 (MMP)-1 upregulation in collagen loss models. Med Glas (Zenica). 2025;22(1):9-14.
https://doi.org/10.17392/1923-22-01Gao W, Yuan LM, Zhang Y, Huang FZ, Gao F, Li J, Xu F, Wang H, Wang YS. miR-1246-overexpressing exosomes suppress UVB-induced photoaging via regulation of TGF-β/Smad and attenuation of MAPK/AP-1 pathway. Photochem Photobiol Sci. 2023;22(1):135-146.
https://doi.org/10.1007/s43630-022-00304-1Разумовская Е.А., Мураков С.В., Капулер О.М., Калашникова Н.Г., Главнова А.М., Князькова Е.Н., Тимофеев А.В. Экзосомы в эстетической медицине и дерматологии: обзор и опыт клинического применения. Медицинский совет. 2025;(14):168-182.
Razumovskaya EA, Murakov SV, Kapuler OM, Kalashnikova NG, Glavnova AM, Knyzkova EN, Timofeev AV. Exosomes in aesthetic medicine and dermatology: A review and clinical experience. Meditsinskiy sovet = Medical Council. 2025;(14):168-182. (In Russ.).
https://doi.org/10.21518/ms2025-347Капулер О.М., Калашникова Н.Г., Разумовская Е.А., Мураков С.В., Главнова А.М., Тимофеев А.В., Князькова Е.Н., Никитина Е.А. Протоколы применения экзосом в косметологии. Эстетическая медицина. 2025;XXIV(4):428-439.
Kapuler OM, Kalashnikova NG, Razumovskaya EA, Murakov SV, Glavnova AM, Timofeev AV, Knyzkova EN, Nikitina EA. Protocols for the use of exosomes in cosmetology. Aesthetic Medicine. 2025;XXIV(4):428-439. (In Russ.).Famta P, Shah S, Khatri DK, Guru SK, Singh SB, Srivastava S. Enigmatic role of exosomes in breast cancer progression and therapy. Life Sci. 2022;289:120210.
https://doi.org/10.1016/j.lfs.2021.120210Miron RJ, Estrin NE, Sculean A, Zhang Y. Understanding exosomes: Part 2 — Emerging leaders in regenerative medicine. Periodontol 2000. 2024;94(1):257-414.
https://doi.org/10.1111/prd.12561Liu J, Ren L, Li S, Li W, Zheng X, Yang Y, Fu W, Yi J, Wang J, Du G. The biology, function, and applications of exosomes in cancer. Acta Pharm Sin B. 2021;11(9):2783-2797.
https://doi.org/10.1016/j.apsb.2021.01.001Yang M, Sun M, Zhang H. The Interaction Between Epigenetic Changes, EMT, and Exosomes in Predicting Metastasis of Colorectal Cancers (CRC). Front Oncol. 2022;12:879848.
https://doi.org/10.3389/fonc.2022.879848Tang W, Xia M, Liao Y, Fang Y, Wen G, Zhong J. Exosomes in triple negative breast cancer: From bench to bedside. Cancer Lett. 2022;527:1-9.
https://doi.org/10.1016/j.canlet.2021.12.009Nestor MS, Ablon G, Gade A, Han H, Fischer DL. Treatment options for androgenetic alopecia: Efficacy, side effects, compliance, financial considerations, and ethics. J Cosmet Dermatol. 2021;20(12):3759-3781.
https://doi.org/10.1111/jocd.14537Zhou C, Zhang B, Yang Y, Jiang Q, Li T, Gong J, Tang H, Zhang Q. Stem cell-derived exosomes: emerging therapeutic opportunities for wound healing. Stem Cell Res Ther. 2023;14(1):107.
https://doi.org/10.1186/s13287-023-03345-0
прочитано
180
раз